Struktura atoma i periodni sistem elemenata
Proton, neutron, elektron, maseni i redni broj
Kod neutralnog atoma bilo kog elementa, broj elektrona u omotaču jednak je broju protona u jezgru. Prema tome:
N(p) = N(e) = 19
Iz uslova zadatka da je
N(p) = N(n) - 1sledi:
N(n) = N(p) + 1 = 19 + 1 = 20
Maseni broj atoma jednak je zbiru broja protona i broja neutrona u jezgru, tako da je:
A = N(p) + N(n) = 19 + 20 = 39
N(n) - broj neutrona
N(p) - broj protona
N(e) - broj elektrona
A - maseni broj
Z - redni broj
Z = N(e)
A = N(p) + N(n)
N(p) = N(e)
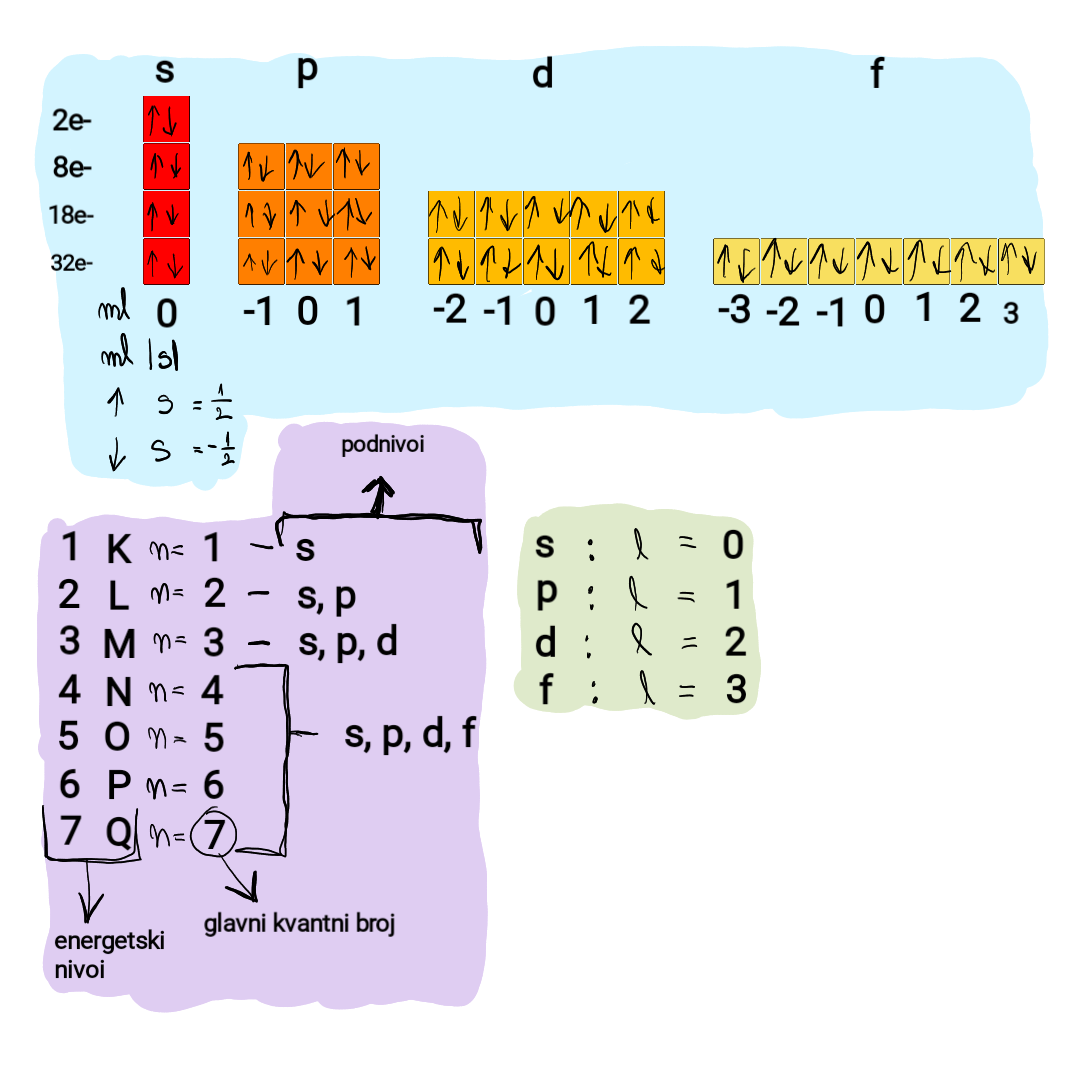
Elektronska konfiguracija
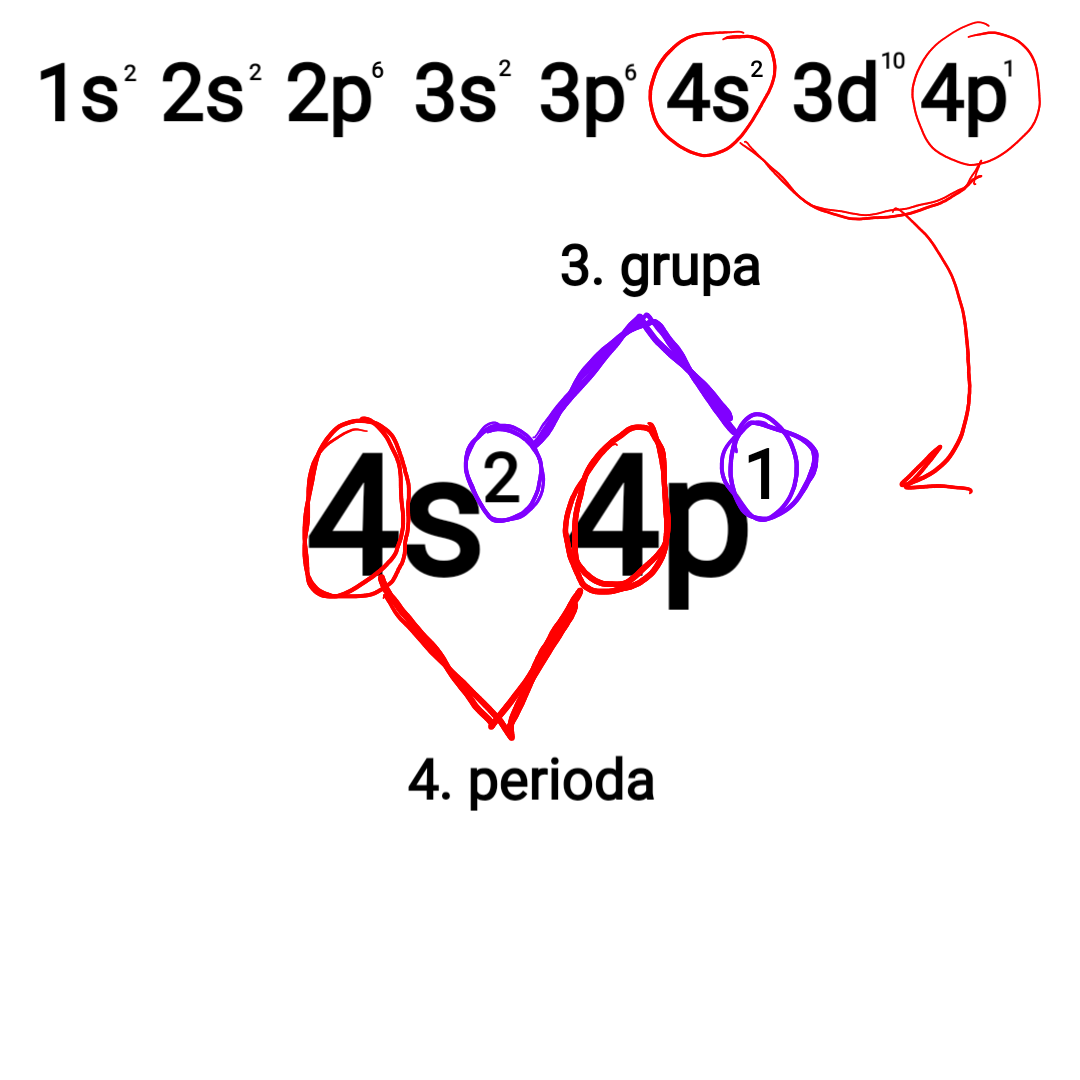
U skladu sa redosledom popunjavanja elektronskih nivoa i podnivoa atom sa rednim brojem 31 ima elektronsku konfiguraciju:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1
Iz navedene elektronske konfiguracije vidi se da kod atoma sa rednim brojem 31 započinje popunjavanje 4p elektronskog podnivoa.
Izotopi su atomi istog hemijskog elementa, koji imaju isti redni, a različit maseni broj.
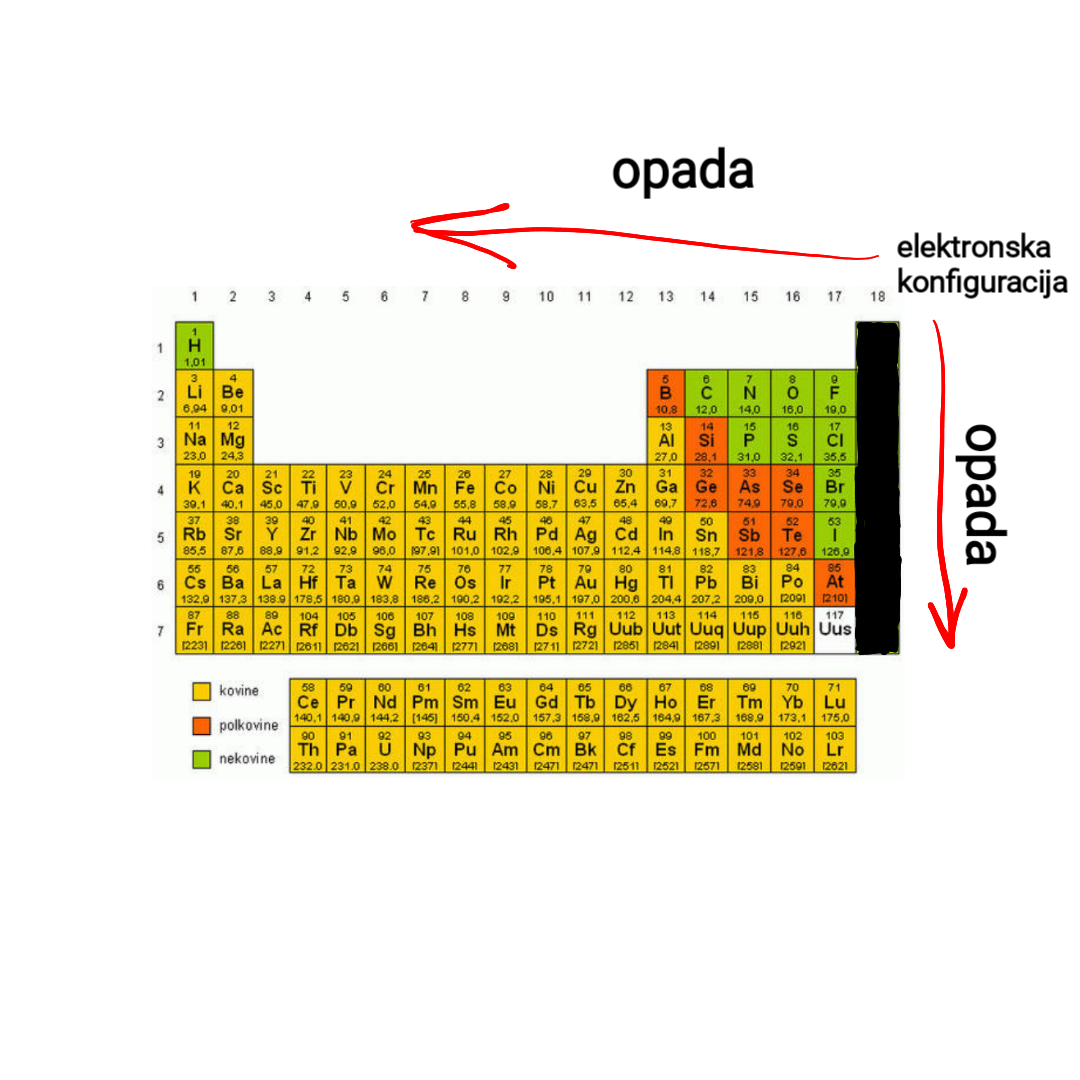
Elementi iste grupe imaju slične osobine.
Energija jonizacije
Relativno male vrednosti energije jonizacije karakteristične su za metale (najmanje su kod alkalnih metala), a najveće vrednosti od svih elemenata imaju plemeniti gasovi. U skladu sa tim, jedino se u nizu: Li, B, N, O, Ne, pojavljuje logičan redosled.
U periodi energija jonizacije raste, a u grupi opada.

Elektronska konfiguracija nemetala
Za elektronske konfiguracije nemetala karakteristično je da imaju relativno veliki broj elektrona u s i p podnivoima poslednjeg nivoa (najčešće 7 ili 6), ali ne i 8 jer su popunjeni s i p karakteristični za plemenite gasove koje treba jasno razlikovati od nemetala.